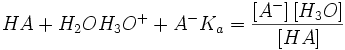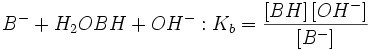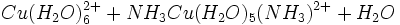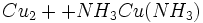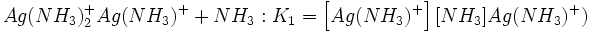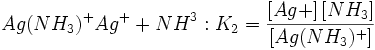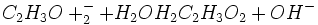اطلاعات اولیه
آب اکسیژنه خالص H2O2 یک مایع ناروانی است که کمی آبی رنگ میباشد و با زحمت زیاد میتوان آنرا تهیه نمود. آب اکسیژنهای که در داروخانهها به اسم آب اکسیژنه رقیق فروخته میشود محلولی است از آب اکسیژنه در آب که در 100 قسمت آن سه قسمت آب اکسیژنه است و مانند آب بیرنگ و بیبوست و مزه تلخی دارد و کمی اسیدی است.
خصوصیات آب اکسیژنه
به مرور آب اکسیژنه تجزیه و تبدیل به آب واکسیژن میگردد. این عمل تجزیه در محیط بازی سریعتر و محیط اسیدی کندتر تا در محیط خنثی صورت میگیرد. ممکن است که اگر مدت مدیدی آب اکسیژنه را انبار کنند، کاملا تجزیه و تبدیل به آب گردد. بر اثر گرد بعضی اجسام عمل تخریب آب اکسیژنه تسریع میگردد مانند گرد بیاکسید منگنز و گرد فلزات و …
اگر بر روی محلول آب قدری از اجسام پایدار کننده مانند اسید فسفریک اوره اسید بنزوئیک و نظیر آنها بیافزایند، عمل تخریب بسیار کند میگردد. آب اکسیژنه اثر میکروب کشی و بوبری دارد چنانکه اگر یک تکه کالباس قرمز را درون ظرف محتوی آب اکسیژنه قرار دهیم پس از چند روز محتویات ظرف کاملا بیبو است و بوی گندیده نمیدهد. آب اکسیژنه رنگها را نیز تخریب میکند بهمین دلیل تکه کالباس درون ظرف بعد از مدتی بیرنگ میشود.
موارد استعمال آب اکسیژنه
از آنجایی که آب اکسیژنه بوبر است در موقع معالجه زخمهای بدبو مورد استعمال قرار میگیرد.
همچنین لکه شراب قرمز و خون و قهوه و غیره را هم میتوان بوسیله آب اکسیژنه پاک نمود. در قرصهای اریتزون آب اکسیژنه به اوره متصل است و چون این قرصها را در دهان بگذارند، اکسیژن میدهد. پس هم میکروبهای دهان را میکشد و هم دندانها را سفید مینماید.
بسیاری از خمیر دندانها و سایر اجسامی که برای پاک کردن دندانها بکار میرود در موقع استعمال تولید آب اکسیژنه میکنند و اکسیژن این آب اکسیژنه دندان را سفید مینماید.
آب اکسیژنه در بیرنگ کردنشاخ ، پشم گوسفند پنبه کنف ، کاه ، چوب کاغذ روغن ابریشم، عاج ، پر و غیره بکار میرود. رنگ بعضی لکههای صورت را هم آب اکسیژنه تخریب میکند. اگر موی سیاه را پس از شستن با کربنات سدیم ( تا چربی آن برطرف شود ) در محلول آب اکسیژنه بگذارند به رنگ روشن در میآید.
اگر موی سیاه سر را با مخلوطی از 100 گرم آب اکسیژنه 30% و چهار قطره محلول آمونیاک تر نمایند و پس از 10 تا 20 دقیقه با آب خالص و سپس با محلول اسید استیکدار بشویند، بور مایل به قرمز میشود.
وجود آمونیاک از این جهت لازم است که آب اکسیژنه در حضور قلیاییها سریعتر اکسیژن میدهد و در نتیجه موها تندتر بور میشوند. مصرف مکرر آب اکسیژنه برای مو مضر است زیرا که مو را شکننده مینماید. در جنگ جهانی آب اکسیژنه 85%برای اکسیداسیون سریع الکل در زیر دریاییها و موشکها مصرف میکردند. آب اکسیژن رقیق را برای قرقره کردن هم بکار میبرند. شناسایی آب اکسیژنه
در یک لوله آزمایشی که قبلا چند سانتیمتر مکعب محلول بیکرمات پتاسیم و قدری اسید سولفوریک رقیق ریختهایم آب اکسیژنه میافزاییم در نتیجه رنگ آبی تند که بعدا تبدیل به سبز میشود، ظاهر میگردد. بهمین طریق میتوان وجود آب اکسیژنه را در اریتزن ثابت نمود.
منبع: دانشنامه رشد





 جواب بصورت نقل قول
جواب بصورت نقل قول