مول (Mole)
اطلاعات اوليه
چون وزن اتمي فلوئور 19.0 و وزن اتمي هيدروژن 1.0 است، سنگيني يك اتم فلوئور 19 برابر يك اتم هيدروژن خواهد بود. حال اگر 100 اتم فلوئور و 100 اتم هيدروژن را در نظر بگيريم، جرم مجموع اتمهاي فلوئور 19 برابر جرم اتمهاي هيدروژن ميشود. پس جرمهاي هر دو نمونهاي از فلوئور و هيدروژن كه عمده اتمهاي آنها برابر باشد همان نسبت 19.0 به 1.0 يعني نسبت وزنهاي اتمي آنها ، خواهد بود.
اگر 19.0g فلوئور و 1.0g هيدروژن داشته باشيم. اين دو مقدار بر حسب گرم و از لحاظ عددي برابر وزنهاي اتمي اين دو عنصر است. چون جرمهاي اين دو نمونه نسبت 19.0 به 1.0 دارد، نمونهها بايد شامل تعداد اتمهاي مساوي باشند. در واقع ، نمونهاي از هر عنصر كه جرم آن بر حسب گرم عددي برابر با وزن اتمي آن عنصر باشد، شامل اين عده اتمهاي يكسان خواهد بود.
اين عدد را به افتخار آمدو آووگادرو عدد آووگادرو مينامند. آووگادرو نخستين كسي بود كه رفتار گازها در واكنش شيميايي را بر حسب عده مولكولها واكنش دهنده ، توضيح داد. مقدار عدد آووگادرو با آزمايش معين شده و تا شش رقم با معني عبارت است از:6.02205x10**23
تعريف مول
مقدار خالصي كه شامل عدد آووگادرو واحد اصلي باشد يك مول ناميده ميشود كه يك واحد اصلي است. تعريف مول مقدار ماده خالصي است كه تعداد واحدهاي مستقل اصلي آن دقيقا برابر با تعداد اتمهاي 12g كربن 126C باشد.
پس نمونهاي از يك عنصر كه جرم آن بر حسب گرم از لحاظ عددي برابر با وزن اتمي آن عنصر باشد، شامل يك مول از اتمهاي آن عنصر ، يعني شامل عدد آووگادرو اتم است. مثلا وزن اتمي بريليم 9.01218 است.
بنابر اين : اتم بريليم Be=1mol Be = 6.02205x10**23 9.01218
مول ماده مولكولي
يك مول مركب از عدد آووگادرو واحد مستقل است. يك مول ماده مولكولي مركب از عدد آدوگادرو مولكول و جرمي بر حسب گرم دارد كه از لحاظ عددي برابر با وزن مولكولي آن ماده است. مثلا وزن مولكولي H2O برابر 18.02 گرم است، پس مولكول H2O با
18.02g H2O =1MolH2O =6.02205x10**23 مولكول آب H2O .
چون يك مولكول آب دو اتم H و يك اتم O دارد، يك مول H2O شامل دو اتم H و يك مول اتم O است.
با استفاده از تعريف مول، نوع واحد مستقلي كه اندازه گيري ميشود بايد مشخص باشد. يك مول از اتم هاي H شامل 6.02205x10**23 اتم H و جرم آن ، تا سه رقم با معني ، 1.01g است، يك مول از مولكولهاي H2 شامل 6.02205x10**23 مولكول H2 و جرم آن 2.02g است. براي فلوئور : فلوئو گرم MolF=6.02205x10**23 F=19.0
مولكول فلووئور 1MolF2=6.02205x10**23 F2=38.0g
مول در مواد يوني
وقتي مي گوييم يك مول(BaCl2) به اين معني است كه نمونه مورد نظر ما شامل عدد آووگادرو واحد فرمولي است كه واحد مستقل آن مشخص است. يك مول BaCl2 جرمي برابر 208.3g دارد كه همان وزن فرمولي BaCl2 است. در واقع ، يك مول BaCl2 شامل ، باريم
137.3g= يون 1MolBa2=6.02205x10**23Ba2
كلر: 71.0g= يون 2MolCl2=6.02205x10**23BaCl2
كه روي هم ميشود :
208.3g Bacl2= واحد 1MolBaCl2=6.02205x10 **23Cl2
(** به معني به توان مي باشد. 10 به توان 23 )
خوب است بدانيد:
در سال 1811 آمادئو آووگادرو، قانون تركيب حجمي را توضيح داد. اصل آووگادرو ميگويد: حجمهاي مساوي همهي گازها در دما و فشار يكسان، داراي تعداد مولكولهاي برابر هستند. به عكس، تعداد مولكولهاي برابر از هر دو گاز، تحت شرايط دما و فشار يكسان، حجمهاي برابر را اشغال ميكنند. يك مول از يك ماده داراي 23**10*022/6 ذره است. بنابراين در شرايط دما و فشار يكسان، يك مول از يك گاز حجمي برابر با يك مول از هر گاز ديگر اشغال ميكند. در شرايط متعارفي اين حجم، به حجم مولي گاز در شرايط متعارفي موسوم است و برابر با 414/22 ليتر ميباشد.
- تعداد واحدها در يك مول به افتخار آمادئو آووگادرو ، عدد آووگادرو ناميده ميشود . وي نخستين كسي بود كه رفتار گازها را برحسب تعداد مولكولهاي واكنش دهنده توجيه كرد .
درواقع آقاي آووگادرو خودش مقدار عددي اين عدد را نتوانست به دست آورد، اما چون وي رفتار گازها را بر حسب تعداد مولكولهاي واكنش دهنده را مورد بررسي قرار داد، بعدها كه اين عدد بدست آمد، به افتخار آووگادرو كه بنيان گذار اين كار بود، به نام وي نام گذاري نمودند.
مقدار اين عدد با روشهاي الكترو شيميايي و بلور شناسي معين شده است . در روش بلور شناسي مثلا يك عنصر را در نظر ميگيرند سپس با دستگاههاي دقيق ساختار عنصر و طول هريك از اضلاع سلول واحد بلور و وزن اتمي عنصر و وزن حجمي آن را مشخص ميكنند . سپس به كمك يك عمليات رياضي ميتوان به عدد آووگادرو دست يافت به عنوان مثال نيكل در سيستم مكعبي با وجوه مركز پر متبلور ميشود . طول هر يك از اضلاع سلول واحد 52/3 آنگسترم ، وزن اتمي نيكل 7/58 و وزن حجمي آن 94/8 است .حال به كمك اين دادهها عدد آووگادرو را حساب ميكنيم : هر سلول واحد داراي چهار اتم نيكل است . اگر عدد آووگادرو را N در نظر بگيريم ، وزن هر اتم برابر( 7 /58 تقسيم بر N) گرم خواهد بود . وزن هر سلول واحد چهار برابر اين مقدار و حجم آن برابر( 52/3 ضرب در ده به توان منفي هشت ) كل اين مقدار به توان سه ، سانتيمتر مكعب است . حال اكر اين دو را تقسيم كنيم چگالي نيكل بدست ميآيد كه البته ضريبي است از Nبا توجه به اينكه ميدانيم چگالي نيكل برابر است با 94/8 پس با ميتوانيم مقدار N را كه همان عدد آووگادرو است حساب كرد . اگر بخواهيم از روش الكترو شيمي استفاده كنيم بايستي عدد فاراده را تقسيم بر بار يك الكترون تنها كنيم كه در اين صورت مقدار عدد آووگادرو حساب ميشود .
كاربرد عدد آووگادرو
براي بيان مفهوم اتم گرم
شيميدانها جرم يك مول يا 6.023*10**23اتم را اتم گرم ميگويند و آنرا برحسب گرم بيان ميكنند. براي مثال اتم اكسيژن ، 16 گرم و اتم كربن ، 12 گرم است؛ يعني جرم يك مول از اتمهاي اكسيژن كه شامل 6.023*10**23اتم است، برابر 16 گرم و به همين ترتيب ، جرم يك مول از اتمهاي كربن برابر 12 گرم است.
مفهوم مولكول گرم
بديهي است جرم يك مول از مولكولهاي يك ماده كه «مولكول گرم» ناميده ميشود. به كمك اتم گرم اتمهاي سازنده آن به آساني قابل محاسبه است. براي مثال ، مولكول گرم اكسيژن O2 برابر مجموع دو اتم اكسيژن 16+16=32گرم و مولكول گرم CO2برابر است با مجموع دو اتم اكسيژن و يك اتم كربن 44=16+16+12 گرم است.
مفهوم جرم مولكولي
شمار اجزاي يك مول برابر با عدد آووگادرو است. تعداد مولكولهاي موجود در يك مول از يك تركيب مولكولي ، برابر با عدد آووگادرو است و جرم آن بر حسب گرم برابر با وزن مولكولي آن تركيب است. براي مثال ، وزن مولكولي H2Oبرابر با 18.02 است. در نتيجه داريم:
1mol H2O= 6.023*10**23 H2O
مولكول چون يك مولكول آب داراي يك اتم O است يك مولكول H2Oشامل دو اتم از اتم H و يك مولكول از اتم O است





 جواب بصورت نقل قول
جواب بصورت نقل قول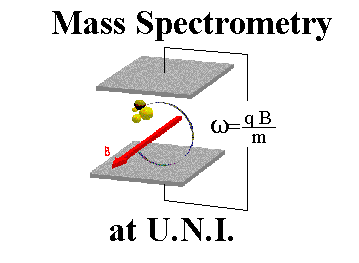
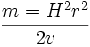
 از معادله فوق چنین بر میآید که هر قدر ، مقدار m/e بزرگتر باشد، شعاع انحنای مسیر نیز بزرگتر خواهد بود. لوله تجزیهگر دستگاه طوری ساخته شده است که دارای شعاع انحنای ثابتی است. ذرهای که نسبت m/e صحیحی داشته باشد، قادر خواهد بود تا طول لوله تجزیهگر منحنی شکل را طی کرده ، به آشکار کننده نمیرسند. مسلما اگر دستگاه ، یونهایی را که جرم بخصوصی دارند، نشان دهد. این روش چندان جالب نخواهد بود.
از معادله فوق چنین بر میآید که هر قدر ، مقدار m/e بزرگتر باشد، شعاع انحنای مسیر نیز بزرگتر خواهد بود. لوله تجزیهگر دستگاه طوری ساخته شده است که دارای شعاع انحنای ثابتی است. ذرهای که نسبت m/e صحیحی داشته باشد، قادر خواهد بود تا طول لوله تجزیهگر منحنی شکل را طی کرده ، به آشکار کننده نمیرسند. مسلما اگر دستگاه ، یونهایی را که جرم بخصوصی دارند، نشان دهد. این روش چندان جالب نخواهد بود. 


